Argonaute(Ago)蛋白是一类在生物界中广泛存在的保守蛋白家族,真核生物Ago(eAgo)由四个结构域组成:N端结构域、PAZ结构域、MID结构域和PIWI结构域,它们通过两个连接区(L1和L2)相连,并作为RNA诱导沉默复合物(RISC)的核心成分,在RNA干扰中发挥关键作用。
原核生物同样广泛存在Ago蛋白(prokaryotic Argonaute, pAgo),且其多样性更为显著。根据结构域组成,pAgo可分为长pAgo与短pAgo,其中短pAgo占比超过60%。而短pAgo仅含有MID结构域和一个催化失活的PIWI结构域,因此不具备切割靶核酸的能力。这类蛋白通常与编码TIR、Sir2、DUF3457等特征结构域的基因位于同一操纵子,形成有功能的蛋白质复合物。目前,短的pAgo介导的抗噬菌体机制研究有限。欧阳松应团队2024年关于原核生物的SPARSA系统的研究,发现pAgo和相关效应蛋白形成一个带正电通道,而gRNA和tDNA结合在该通道,进而引发细胞内NAD+的快速耗竭导致流产感染,起到抗噬菌体感染作用(Nat Commun丨欧阳松应/龙凤/李金宇合作揭示效应蛋白SPARSA系统在细菌免疫中的激活机制)。
SPARDA(Short Prokaryotic Argonaute and DNAse/RNase-Endonuclease)是一种新型抗噬菌体系统,该系统将APAZ结构域与一个DREN核酸酶结构域融合,在识别外源核酸后,SPARDA通过DREN核酸酶结构域对多种核酸底物产生广泛的“附带”切割活性。然而,关于SPARDA的组装机制及其非特异性核酸酶活性的激活机理仍有待阐明。
近日,我校欧阳松应团队与厦门大学夏宁邵院士团队合作,在《Nature Communications》上在线发表题为“Filament assembly induced by the recognition of target DNA activates the prokaryotic Argonaute SPARDA system”的论文,对来自Novosphingopyxis baekryungensis的SPARDA系统进行了深入研究,通过冷冻电镜技术揭示了与gRNA完全配对的tDNA可诱导SPARDA组装成纤维状结构,并且该纤维状组装导致DREN核酸酶结构域发生四聚化,从而激活其核酸酶活性。
研究首先解析了SPARDA-gRNA复合物的冷冻电镜结构(分辨率2.77Å),发现gRNA诱导了SPARDA的二聚化,由pAgo和DREN-APAZ形成二聚体。为了进一步阐明tDNA识别gRNA时DREN被激活的机制,团队进一步解析了SPARDA-gRNA-tDNA三元复合物的冷冻电镜结构(分辨率2.64Å),发现gRNA和tDNA结合后,会诱导SPARDA形成纤维状结构(图1)。研究团队进一步解析了SPARDA形成纤维状结构,发现在纤维状结构中DREN结构域会形成一个四聚体,并形成有利于底物结合的通道,从而促进核酸底物的积累和切割。他们意外捕捉到了DREN结构域结合过量的gRNA-tDNA的状态,为理解SPARDA的底物切割机制提供了重要证据。
通过一系列冷冻电镜结构的解析,研究团队揭示了SPARDA在靶DNA激活过程中经历“单体 → 二聚体 → 单体 → 丝状结构”的动态转变(图2)。这些结果共同阐明了一种依赖纤维状组装的激活机制,为理解短pAgo介导的抗病毒免疫应答提供了重要的结构基础。
我校生命科学学院欧阳松应教授、王勖荣博士和厦门大学夏宁邵院士团队郑清炳高级工程师、李少伟教授为共同通讯作者。我校生命科学学院在读博士生张婉月、甄向凯研究员、厦门大学博士生江羽宸、李煜为共同第一作者。该工作得到国家自然科学基金等项目资助。
全文链接:https://www.nature.com/articles/s41467-025-68195-1

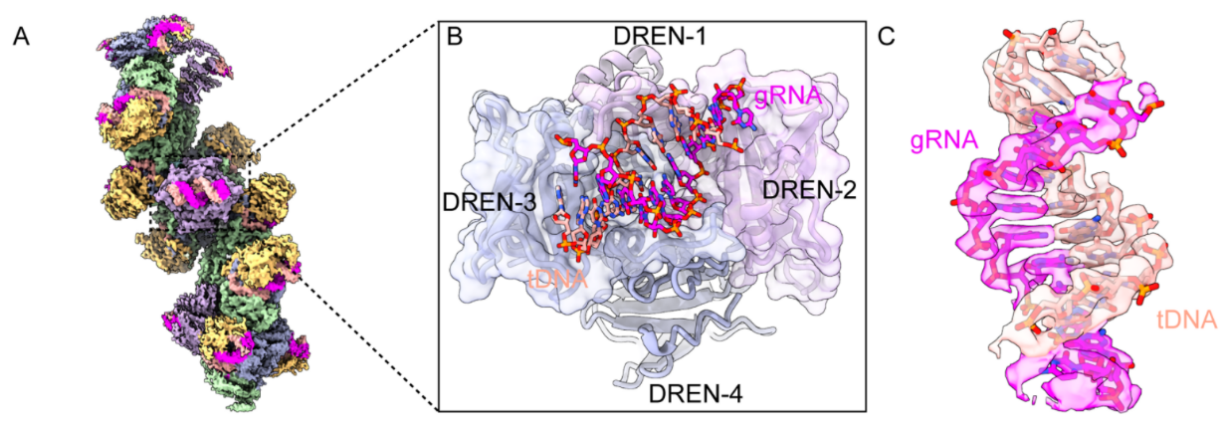
图1
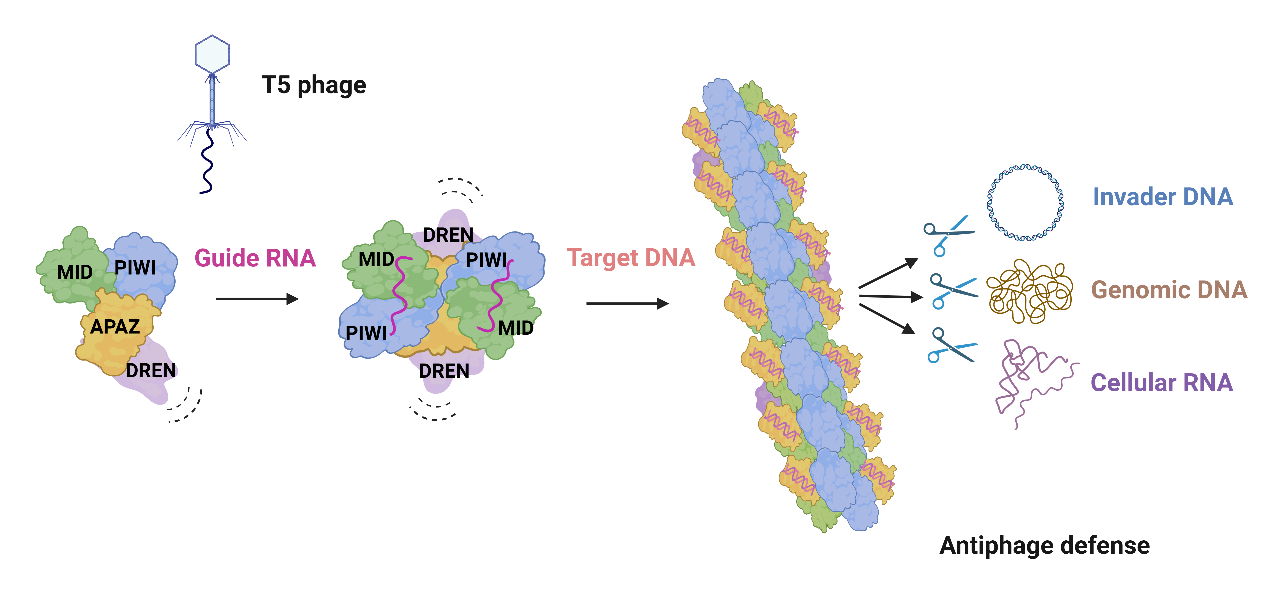
图2
(科学技术处、生命科学学院)
